Cancer Discovery | 樊嘉/吴逵/高强揭示肝内胆管癌的肿瘤-免疫时空互作及治疗新策略
发布时间:2022-8-18 9:30:36更新时间:2022-8-18 9:33:42
肝内胆管癌是第二大原发性肝癌(占原发肝癌10-15%),是预后最差的肿瘤之一【1】,免疫治疗应答律极低【2】。肿瘤免疫浸润及免疫编辑的时空异质性,可能对肿瘤的演化轨迹及治疗相应产生深刻的影响【3】。但是,“免疫逃逸的时空分布规律”以及“肿瘤-免疫互作的时空特征”等科学问题仍存在诸多未知。因此,进一步深入探索肿瘤-免疫的时空关系,可加深对肝内胆管癌发生发展和免疫耐受的理解,促进个体化靶向和免疫治疗的开发【4-7】。
2022年7月19日,复旦大学附属中山医院肝外科樊嘉院士和高强教授,联合深圳华大生命科学研究院(以下简称“华大研究院”)吴逵研究员团队,在Cancer Discovery上发表题为Geospatial immune heterogeneity reflects the diverse tumor-immune interactions in intrahepatic cholangiocarcinoma的研究论文,基于来自45例患者的207例肝内胆管癌多区域样本和小鼠模型,整合全外显子测序、转录组测序、TCR测序及多色免疫荧光等技术,揭示了肿瘤细胞和免疫微环境的互作规律,为肝内胆管癌精准的个体化免疫联合治疗带来了新希望。

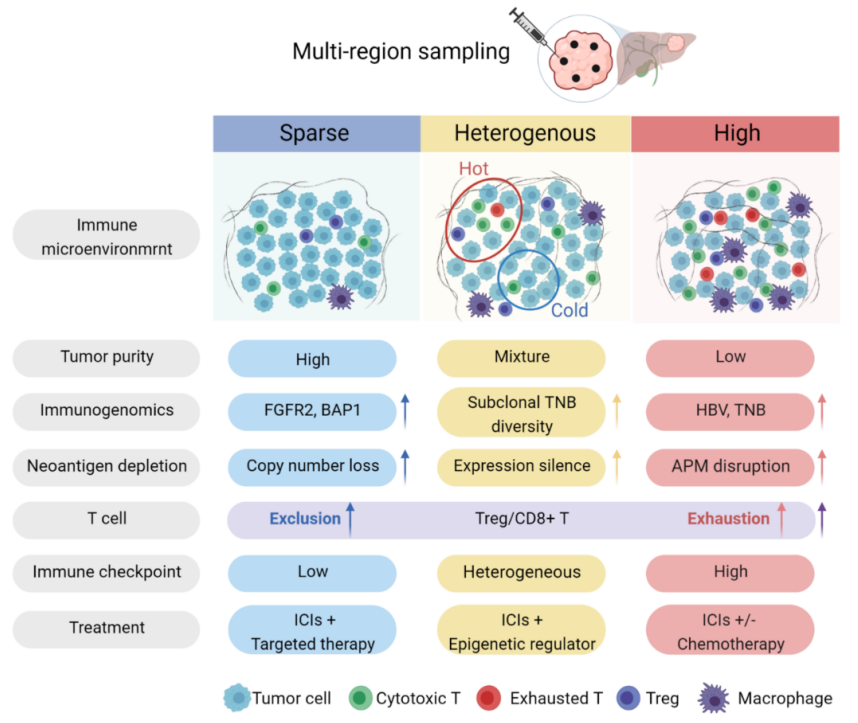
在这项研究中,研究者对手术切除的肝内胆管癌样本进行了多区域取样(4-6个区域/患者),利用免疫基因组学分析发现,肝内胆管癌在基因组水平和免疫微环境水平表现出极高的肿瘤内异质性:同一肿瘤的不同区域之间的基因突变和拷贝数改变差异超过40%,超过一半的肝内胆管癌呈现出异质性的肿瘤内免疫浸润。据此将肝内胆管癌分为低免疫浸润、异质性免疫浸润和高免疫浸润这三种类型。高免疫浸润型具有更高的肿瘤新抗原负荷和趋化因子表达,而低免疫浸润型的细胞周期和氧化磷酸化等信号通路显著上调。此外,还探索了不同驱动突变对免疫微环境的影响,发现FGFR2基因变异驱动的肝内胆管癌具有更低的新抗原负荷和更低的免疫浸润,提示PD1抗体可能需要与FGRF2抑制剂的联合才能在此类胆管癌中取得一定的疗效。
为了进一步探索肿瘤演化和免疫微环境之间的相互作用,研究者系统解析了主克隆新抗原在基因水平(拷贝数丢失)、转录组水平(表达沉默)以及抗原呈递水平(HLA杂合性缺失)的耗竭过程。值得注意的是,超过一半的肿瘤新抗原在上述过程中被耗竭而无法成为免疫细胞的识别靶点。主克隆抗原拷贝数的主动丢失主要发生在免疫低浸润区域,同时DNA免疫编辑可能是其潜在的互补方式,代表了肿瘤在基因水平上的免疫逃逸。异质性免疫浸润肿瘤的主克隆新抗原表达率最低,而高免疫浸润肿瘤展现出更为显著的抗原呈递机制破坏,包括更高频率的HLA等位基因杂合性缺失和抗原呈递相关基因的拷贝数丢失。同时还发现,在异质性浸润肿瘤中,亚克隆新抗原负荷与区域免疫浸润呈现负相关,表明异质性免疫浸润对不同肿瘤区域的亚克隆演化产生了深刻影响。这些结果初步揭示了免疫微环境和肿瘤细胞的相互作用促进肝内胆管癌免疫逃逸的潜在机制。
研究者结合TCR测序和免疫多色荧光的深入分析发现,高免疫浸润肿瘤在不同亚区域之间的TCR谱更加相似,但同时也展现出更显著的T细胞耗竭状态。综合肿瘤的免疫微环境和免疫逃逸机制,将肝内胆管癌分为了免疫低逃逸和高逃逸两组,肿瘤免疫逃逸能力强的患者预后显著更差,这在CPTAC和TCGA胆管癌队列中均得到验证,为肝内胆管癌的预后分型提供了新的视角。
最后,研究者对TP53、KRAS、IDH1/2和BAP1突变来源的免疫多肽进行了HLA结合能力和免疫原性的筛选,发现KRASG12D来源的多肽LVVVGADGV具有较强的免疫原性,同时鉴定了其潜在的特异性TCR的V-J重排和基序(motif),可作为新型个性化免疫治疗靶点。